พันธะเคมี
ทุกสิ่งที่อยู่บนโลกใบนี้เกิดจากหน่วยเล็ก ๆ ที่เรียกว่า อะตอม (Atom) อันที่จริงมันมีสิ่งที่เล็กมากกว่านี้แต่ด้วยระดับความรู้ที่เข้าใจได้ง่าย จับต้องได้ง่ายกว่า ส่วนใหญ่แล้วเราจึงเรียนรู้อยู่ในระดับอะตอม มันอาจจะเป็นอะตอมของธาตุเดี่ยว ๆ หรืออาจจะเกิดการจับคู่ของอะตอมตั้งแต่ 2 อะตอมขึ้นไป และสิ่งที่เกิดขึ้นระหว่างอะตอม เรียกว่า พันธะเคมี (Chemical Bond)
พันธะเคมีของอะตอม คือ แรงยึดเหนี่ยวระหว่างอะตอม ซึ่งเป็นสิ่งที่สำคัญพอ ๆ กับตัวอะตอมเอง เพราะหากมันไม่เกิดการจับตัวกันระหว่างอะตอม ก็อาจจะไม่มีโมเลกุล สสาร สารประกอบ เนื้อเยื่อ อวัยวะ ร่างกาย หรือหน่วยของสิ่งมีชีวิตและไม่มีชีวิตต่าง ๆ ที่อยู่บนโลกนี้เกิดขึ้นได้เลย มันคงจะเป็นแค่อะตอมซึ่งล่องลอยอย่างอิสระไปทั่ว เมื่ออะตอมจับตัวอยู่ด้วยกันจะได้เป็นโมเลกุล โดยแต่ละโมเลกุลก็จะจับตัวกันมากขึ้น เป็นโครงสร้างที่ซับซ้อนมากขึ้น
พันธะเคมีของอะตอม (Atomic Bonds) ประกอบไปด้วย พันธะไอออนิก พันธะโคเวเลนต์ พันธะโลหะ โดยไม่รวมถึงพันธะระหว่างโมเลกุลซึ่งมีความแตกต่างกันออกไปอีก
พันธะไอออนิก (Ionic Bond)
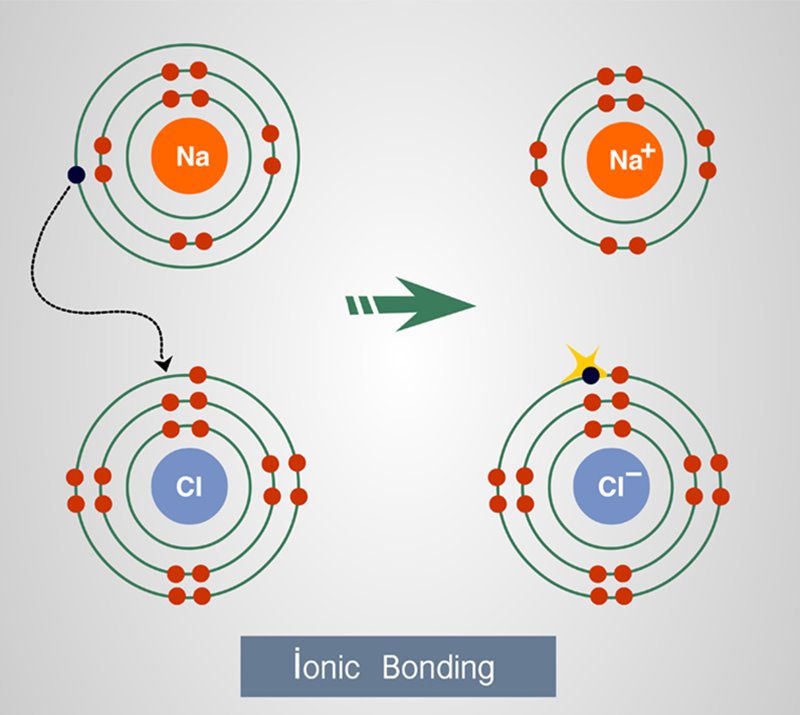
เป็นพันธะที่เกิดขึ้นระหว่างอะตอมซึ่งมีประจุตรงข้ามกัน และดึงดูดเข้าหากันจากการเคลื่อนย้ายอิเล็กตรอนหนึ่งตัวหรือมากกว่า จำนวนอิเล็กตรอนซึ่งอยู่วงนอกสุดของอะตอมหนึ่งไปอยู่ร่วมกับกลุ่มอิเล็กตรอนวงนอกสุดของอีกหนึ่งอะตอม เพื่อให้จำนวนอิเล็กตรอนวงนอกสุดของทั้งสองอะตอมครบออกเตต (Octet)
การจับคู่พันธะแบบไอออนิกนี้เกิดขึ้นระหว่างอะตอมของโลหะกับอะตอมของอโลหะ โดยอะตอมโลหะให้อิเล็กตรอนแก่อะตอมของอโลหะ ยกตัวอย่างเช่น อะตอมโซเดียม (Na) และอะตอมคลอรีน (Cl) กลายเป็นโซเดียมคลอไรด์ (NaCl) หรือเกลือ โซเดียมมีอิเล็กตรอนวงนอกสุด 1 ตัว จึงยกอิเล็กตรอนตัวนี้ให้แก่อะตอมคลอรีน ทำให้อะตอมโซเดียมเองมีประจุเป็นบวก เนื่องจากมีจำนวนอิเล็กตรอนน้อยกว่าโปรตอน 1 ตัว ในฝั่งของอะตอมคลอรีนมีอิเล็กตรอนวงนอกสุด 7 ตัว เมื่อได้รับอิเล็กตรอนเข้ามาเพิ่มอีก 1 ตัวทำให้มีจำนวนอิเล็กตรอนมากกว่าโปรตอนในอะตอมของตัวเองอยู่ 1 และทำให้มันมีประจุเป็นลบ
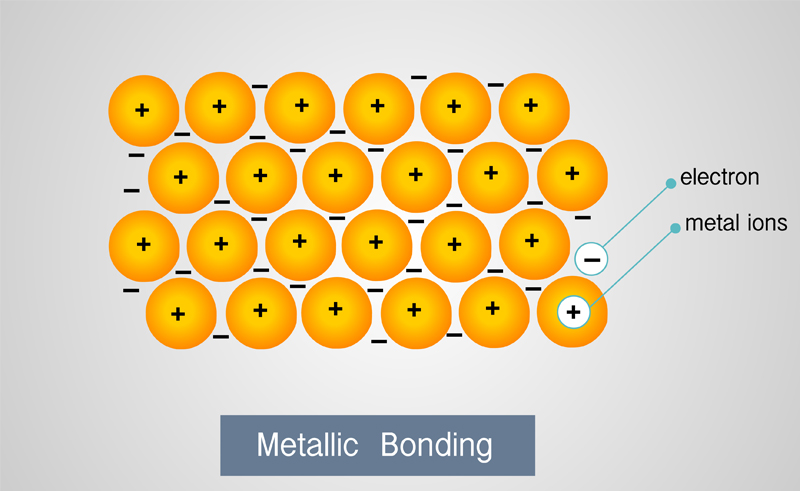
พันธะโลหะ (Metallic Bond)
เป็นพันธะซึ่งเกิดขึ้นกับอะตอมของธาตุที่เป็นโลหะ เกิดขึ้นเมื่ออะตอมของโลหะแบ่งกันใช้อิเล็กตรอนวงนอกสุดของอะตอม โดยที่อิเล็กตรอนที่แบ่งกันใช้นี้ไม่ได้เป็นส่วนหนึ่งของอะตอมใดอะตอมหนึ่งโดยสมบูรณ์ และนั่นทำให้มีการเคลื่อนที่ของอิเล็กตรอนอยู่ตลอดเวลา ทุก ๆ อะตอมของโลหะจึงอยู่ใกล้กับอะตอมอื่นยาวไปอย่างไม่สิ้นสุด และนั่นทำให้ธาตุโลหะไม่มีสูตรโมเลกุล
ยกตัวอย่างเช่น อะตอมของเหล็ก (Fe) อยู่รวมกันเป็นจำนวนมากจนกลายเป็นแผ่นเหล็กหรือแท่งเหล็กได้ โดยไม่มีการกำหนดตัวเลขจำนวนอะตอมในหนึ่งโมเลกุล และการเคลื่อนที่ได้อย่างอิสระของอิเล็กตรอนนี้เองที่ทำให้โลหะสามารถนำประจุไฟฟ้าได้ดี เพราะอิเล็กตรอนที่ถูกเติมเข้ามาในโลหะสามารถไหลจากจุดหนึ่งไปยังจุดใด ๆ ได้อย่างอิสระ ดังนั้น หากมีแท่งเหล็กและมีการต่อไฟฟ้าเข้าที่จุดใดจุดหนึ่งของแท่งเหล็ก เมื่อคุณจับหรือสัมผัสส่วนใดของแท่งเหล็กก็จะช็อตได้ทั้งสิ้น เช่นเดียวกับการถ่ายโอนความร้อนด้วยการนำความร้อนให้กระจายไปทั่ว การเคลื่อนที่ของอิเล็กตรอนที่เป็นอิสระนี้เองก็ทำให้โลหะมีลักษณะมันวาว เนื่องจากความสามารถในการสะท้อนแสงได้ดี นอกจากนั้นการที่แต่ละอะตอมใช้อิเล็กตรอนวงนอกสุดร่วมกัน ทำให้อะตอมอยู่ใกล้ชิดกันอย่างเหนียวแน่นและนั่นทำให้ธาตุโลหะส่วนใหญ่มีจุดหลอมเหลวสูงอีกด้วย
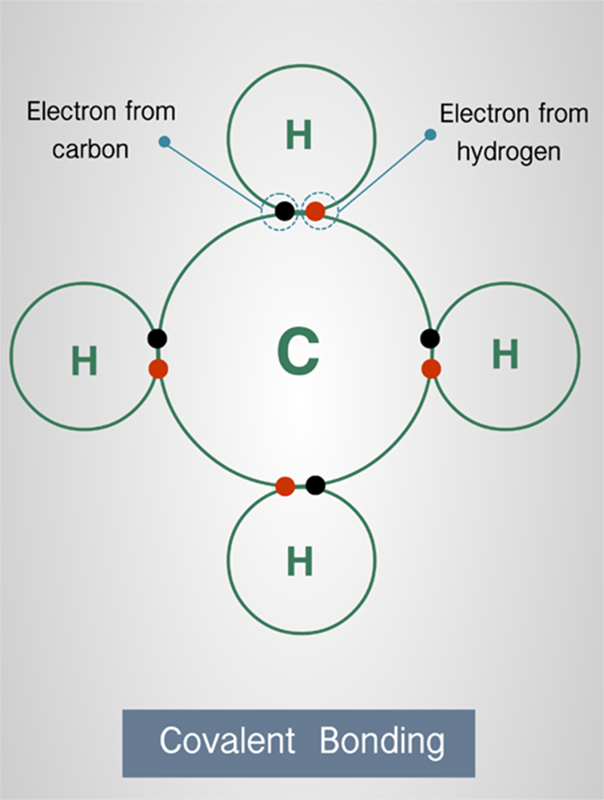
พันธะโคเวเลนต์ (Covalent Bond)
เป็นการใช้อิเล็กตรอนร่วมกันของอะตอมคู่หนึ่ง ซึ่งอะตอมคู่นี้เป็นอะตอมของธาตุอโลหะ คุณสมบัติของอะตอมธาตุอโลหะคือ มีค่าพลังงานไอออไนเซชั่น (Ionization) สูง กล่าวคือ ความสามารถในการยึดเหนี่ยวอิเล็กตรอนเอาไว้ ไม่ยอมปล่อยให้อะตอมอื่นเอาไปใช้ได้ จึงทำให้อะตอมที่มาจับเข้าคู่กันจำเป็นต้องแบ่งปันอิเล็กตรอนกันโดยไม่มีอะตอมไหนสูญเสียอิเล็กตรอนออกไป โดยหลักแล้วคือ การแบ่งปันโดยยอมให้อะตอมอื่นใช้อิเล็กตรอนได้จำนวนเท่า ๆ กันกับที่ดึงดูดอิเล็กตรอนจากอะตอมอื่น นั่นก็เพื่อให้อิเล็กตรอนวงนอกสุดของอะตอมครบจำนวนตามกฎออกเตต
พันธะโคเวเลนต์ยังสามารถแบ่งย่อยออกไปได้อีก 3 แบบ ตามจำนวนคู่ของอะตอมที่แบ่งปันกัน ได้แก่ 1 คู่ 2 คู่ และ 3 คู่ และนั่นทำให้ธาตุอโลหะไม่สามารถอยู่เป็นอะตอมเดี่ยว ๆ ได้ แต่จำเป็นต้องจับตัวคู่กันเป็นอย่างน้อยเพื่อให้เป็นโมเลกุลที่เสถียร โดยยิ่งแบ่งคู่อิเล็กตรอนระหว่างกันมากเท่าไร ก็จะยิ่งมีความยาวพันธะน้อยลง แต่มีพลังงานของพันธะมากขึ้น
ความคิดเห็น
แสดงความคิดเห็น