สถานะของสาร
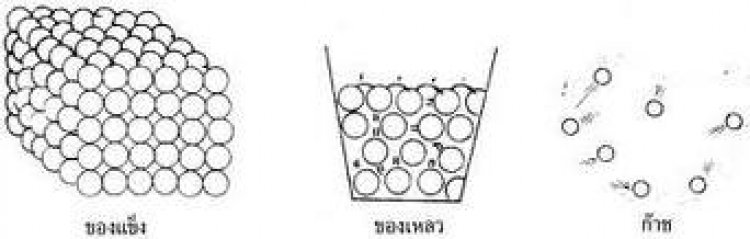
การจัดเรียงตัวของอนุภาคของสาร
สารโดยทั่วไปในธรรมชาติ มี 3 สถานะ ดังนี้
1. ของแข็ง อนุภาคจะอยู่ชิดกัน อนุภาคไม่สามารถเคลื่อนที่ได้ ทำให้แรงยึดเหนี่ยวอนุภาคสูงกว่าในสถานะอื่นของสารชนิดเดียวกัน มีรูปร่างและปริมาตรที่คงที่แน่นอน ไม่ขึ้นกับภาชนะที่บรรจุ ตัวอย่างของสารที่มีสถานะเป็นของแข็ง เช่น เหล็ก อะลูมิเนียม ทองแดง เงิน เป็นต้น
2. ของเหลว อนุภาคอยู่ห่างกันเล็กน้อย ทำให้อนุภาคสามารถเคลื่อนที่ได้ รูปร่างไม่แน่นอน เปลี่ยนตามภาชนะที่บรรจุ แต่ปริมาตรไม่ขึ้นกับภาชนะ ตัวอย่างของสารที่มีสถานะเป็นของเหลว เช่น น้ำ แอลกอฮอล์ โบรมีน เป็นต้น
3. แก๊ส อนุภาคจะอยู่ห่างกัน แรงยึดเหนี่ยวมีค่าน้อย ทำให้เคลื่อนที่ได้มาก มีปริมาตรและรูปร่างตามภาชนะที่บรรจุ ตัวอย่างของสารที่มีสถานะเป็นแก๊ส เช่น แก๊สออกซิเจน แก๊สไฮโดรเจน แก๊สคาร์บอนไดออกไซด์ แก๊สไนโตรเจน เป็นต้น
1. ของแข็ง อนุภาคจะอยู่ชิดกัน อนุภาคไม่สามารถเคลื่อนที่ได้ ทำให้แรงยึดเหนี่ยวอนุภาคสูงกว่าในสถานะอื่นของสารชนิดเดียวกัน มีรูปร่างและปริมาตรที่คงที่แน่นอน ไม่ขึ้นกับภาชนะที่บรรจุ ตัวอย่างของสารที่มีสถานะเป็นของแข็ง เช่น เหล็ก อะลูมิเนียม ทองแดง เงิน เป็นต้น
2. ของเหลว อนุภาคอยู่ห่างกันเล็กน้อย ทำให้อนุภาคสามารถเคลื่อนที่ได้ รูปร่างไม่แน่นอน เปลี่ยนตามภาชนะที่บรรจุ แต่ปริมาตรไม่ขึ้นกับภาชนะ ตัวอย่างของสารที่มีสถานะเป็นของเหลว เช่น น้ำ แอลกอฮอล์ โบรมีน เป็นต้น
3. แก๊ส อนุภาคจะอยู่ห่างกัน แรงยึดเหนี่ยวมีค่าน้อย ทำให้เคลื่อนที่ได้มาก มีปริมาตรและรูปร่างตามภาชนะที่บรรจุ ตัวอย่างของสารที่มีสถานะเป็นแก๊ส เช่น แก๊สออกซิเจน แก๊สไฮโดรเจน แก๊สคาร์บอนไดออกไซด์ แก๊สไนโตรเจน เป็นต้น
การเปลี่ยนสถานะของสาร
การเปลี่ยนสถานะของระบบ จะแบ่งออกเป็น 2 ประเภท คือ
1. คายความร้อน เป็นการถ่ายเทพลังงานจากระบบสู่สิ่งแวดล้อม ทำให้สิ่งแวดล้อมมีอุณหภูมิสูงขึ้น
2. ดูดความร้อน เป็นการถ่ายเทพลังงานจากสิ่งแวดล้อมสู่ระบบ ทำให้สิ่งแวดล้อมมีอุณหภูมิลดลง
2. ดูดความร้อน เป็นการถ่ายเทพลังงานจากสิ่งแวดล้อมสู่ระบบ ทำให้สิ่งแวดล้อมมีอุณหภูมิลดลง
| ข้อสังเกต |
| ระบบ (system) คือ สิ่งที่เราต้องการศึกษา สิ่งแวดล้อม (surrounding) คือ สิ่งที่นอกเหนือจากระบบ ตัวอย่างการเปลี่ยนแปลง เช่น การทดลองเติมโซดาไฟในน้ำ โดยมีบีกเกอร์เป็นภาชนะ จับบีกเกอร์แล้วรู้สึกร้อน ระบบ คือ น้ำและโซดาไฟ สิ่งแวดล้อม คือ บีกเกอร์ เป็นการเปลี่ยนแปลงชนิดคายความร้อน เนื่องจากบีกเกอร์ (สิ่งแวดล้อม) อุณหภูมิสูงขึ้น # จับภาชนะแล้วรู้สึกร้อน แสดงว่าเป็นการเปลี่ยนแปลงแบบคายความร้อน # จับภาชนะแล้วรู้สึกเย็น แสดงว่าเป็นการเปลี่ยนแปลงแบบดูดความร้อน |
การเปลี่ยนแปลงสถานะของสารจะมีพลังงานเข้ามาเกี่ยวข้อง ดังนี้
# การหลอมเหลว (melting) สารเปลี่ยนสถานะจากของแข็งเป็นของเหลว โดยต้องให้ความร้อน ทำให้อนุภาคเอาชนะแรงยึดเหนี่ยวได้ ณ อุณหภูมิที่เรียกว่า จุดหลอมเหลว (melting point) เป็นค่าคงที่ของสารหนึ่งๆ เท่านั้น
# การกลายเป็นไอ (evaporation) สารเปลี่ยนสถานะจากของ เหลวไปเป็นแก๊ส เมื่ออนุภาคของของเหลวมีพลังงานมาก จนทำให้อนุภาคแยกออกจากกัน เรียกอุณหภูมิที่ทำให้อนุภาคชนะแรงยึดเหนี่ยวของของเหลวได้ว่า จุดเดือด (boiling point)
# การแข็งตัว (freezing) สารเปลี่ยนสถานะจากของเหลวเป็นของแข็ง หรือแก๊สเป็นของแข็ง โดยจะมีการคายพลังงานออกมา ทำให้อนุภาคมีพลังงานในการสั่นน้อย อนุภาคจึงเรียงตัวแบบชิดกันมากขึ้น
# การควบแน่น (condensation) สารเปลี่ยนสถานะจากแก๊สเป็นของเหลว เช่น กระบวนการเกิดฝน (ไอน้ำ ระบบความเย็น จะกลั่นตัวเป็น น้ำ)
# การระเหิด (sublimation) สารเปลี่ยนสถานะจากของแข็งเป็นแก๊ส เช่น การระเหิดของลูกเหม็นการเปลี่ยนแปลงสถานะของน้ำ
# ความร้อนแฝง (latent heat) เป็นพลังงานความร้อนที่ใช้เพื่อเปลี่ยนสถานะ (ดูดพลังงาน) โดยอุณหภูมิไม่เปลี่ยนแปลง มี 2 ประเภท คือ
# การกลายเป็นไอ (evaporation) สารเปลี่ยนสถานะจากของ เหลวไปเป็นแก๊ส เมื่ออนุภาคของของเหลวมีพลังงานมาก จนทำให้อนุภาคแยกออกจากกัน เรียกอุณหภูมิที่ทำให้อนุภาคชนะแรงยึดเหนี่ยวของของเหลวได้ว่า จุดเดือด (boiling point)
# การแข็งตัว (freezing) สารเปลี่ยนสถานะจากของเหลวเป็นของแข็ง หรือแก๊สเป็นของแข็ง โดยจะมีการคายพลังงานออกมา ทำให้อนุภาคมีพลังงานในการสั่นน้อย อนุภาคจึงเรียงตัวแบบชิดกันมากขึ้น
# การควบแน่น (condensation) สารเปลี่ยนสถานะจากแก๊สเป็นของเหลว เช่น กระบวนการเกิดฝน (ไอน้ำ ระบบความเย็น จะกลั่นตัวเป็น น้ำ)
# การระเหิด (sublimation) สารเปลี่ยนสถานะจากของแข็งเป็นแก๊ส เช่น การระเหิดของลูกเหม็นการเปลี่ยนแปลงสถานะของน้ำ
# ความร้อนแฝง (latent heat) เป็นพลังงานความร้อนที่ใช้เพื่อเปลี่ยนสถานะ (ดูดพลังงาน) โดยอุณหภูมิไม่เปลี่ยนแปลง มี 2 ประเภท คือ
1. ความร้อนแฝงของการหลอมเหลว (latent heat of fusion) เป็นพลังงานความร้อนที่ดูดเข้าไป เพื่อเปลี่ยนสถานะจากของแข็งเป็นของเหลว โดยอุณหภูมิคงที่
2. ความร้อนแฝงของการกลายเป็นไอ (latent heat of vaporization) เป็นพลังงานความร้อนที่ดูดเข้าไปเพื่อเปลี่ยนสถานะจากของเหลวเป็นแก๊สสารที่เราพบเห็นได้ในชีวิตประจำวันนั้นมีทั้งสารที่อยู่ในสถานะของแข็ง ของเหลว และแก๊ส โดยสารสามารถเปลี่ยนจากสถานะหนึ่งไปเป็นอี
2. ความร้อนแฝงของการกลายเป็นไอ (latent heat of vaporization) เป็นพลังงานความร้อนที่ดูดเข้าไปเพื่อเปลี่ยนสถานะจากของเหลวเป็นแก๊สสารที่เราพบเห็นได้ในชีวิตประจำวันนั้นมีทั้งสารที่อยู่ในสถานะของแข็ง ของเหลว และแก๊ส โดยสารสามารถเปลี่ยนจากสถานะหนึ่งไปเป็นอี
สถานะหนึ่งได้ ซึ่งเกิดจากการเปลี่ยนแปลงพลังงานประเภทดูดหรือคายพลังงาน และสามารถทำให้สารเปลี่ยนกลับมาอยู่ในสถานะเดิมได้อีกด้วย เช่น น้ำแข็งเมื่อได้รับความร้อนจะหลอมเหลวกลายเป็นน้ำ และเมื่อน้ำได้รับความร้อนสูงๆ จนถึงจุดเดือดจะกลายเป็นไอน้ำ ซึ่งไอน้ำนี้สามารถควบแน่นกลับมาเป็นน้ำได้ และเมื่อน้ำได้รับความเย็นจนถึงจุดเยือกแข็งจะกลับมาอยู่ในรูปของน้ำแข็ง เป็นต้น
การเปลี่ยนสถานะของสารจากของแข็งไปเป็นของเหลว และจากของเหลวไปเป็นแก๊ส จะต้องให้ความร้อนแก่สาร เพื่อให้แรงยึดเหนี่ยวระหว่างอนุภาคของสารลดลง ทำให้อนุภาคของสารเกิดการจับตัวกันน้อยลง และเกิดช่องว่างระหว่างอนุภาคมากขึ้น
การเปลี่ยนสถานะของสารจากแก๊สกลับมาเป็นของเหลว และจากของเหลวกลับมาเป็นของแข็ง จะต้องลดอุณหภูมิของสาร เพื่อให้แรงยึดเหนี่ยวระหว่างอนุภาคของสารเพิ่มขึ้น ทำให้อนุภาคของสารเกิดการจับตัวกันมากขึ้น และเกิดช่องว่างระหว่างอนุภาคน้อยลง
การเปลี่ยนสถานะของสารจากแก๊สกลับมาเป็นของเหลว และจากของเหลวกลับมาเป็นของแข็ง จะต้องลดอุณหภูมิของสาร เพื่อให้แรงยึดเหนี่ยวระหว่างอนุภาคของสารเพิ่มขึ้น ทำให้อนุภาคของสารเกิดการจับตัวกันมากขึ้น และเกิดช่องว่างระหว่างอนุภาคน้อยลง
เราสามารถใช้ประโยชน์จากการเปลี่ยนสถานะของสารได้ดังนี้
1. การเปลี่ยนสถานะของสารจากของแข็งเป็นของเหลว เช่น การหล่อเทียน การหล่อพระพุทธรูป การหล่อเครื่องมือเครื่องใช้ต่างๆ โดยนำสารที่จะหล่อมาหลอมเหลวแล้วใส่ในแม่พิมพ์ เป็นต้น
2. การเปลี่ยนสถานะของสารจากของแข็งเป็นแก๊ส เช่น การระเหิดของลูกเหม็น เป็นต้น
3. การเปลี่ยนสถานะของสารจากแก๊สไปเป็นของเหลว เช่น การทำฝนเทียมโดยใช้สารเคมีเพื่อทำให้เกิดการควบแน่นของไอน้ำในอากาศกลายเป็น ฝน ในกระบวนการกลั่นน้ำมันปิโตรเลียม ต้องอาศัยหลักการควบแน่นของสาร เป็นต้น
4. การเปลี่ยนสถานะของสารจากของเหลวไปเป็นแก๊ส เช่น การทำน้ำให้เดือดเพื่อฆ่าเชื้อโรคในน้ำ การผลิตกระแสไฟฟ้าจากแรงดันไอของน้ำเดือด เป็นต้น
5. การเปลี่ยนสถานะของสารจากของเหลวไปเป็นของแข็ง เช่น การทำน้ำแข็ง การทำไอศกรีม เป็นต้น
2. การเปลี่ยนสถานะของสารจากของแข็งเป็นแก๊ส เช่น การระเหิดของลูกเหม็น เป็นต้น
3. การเปลี่ยนสถานะของสารจากแก๊สไปเป็นของเหลว เช่น การทำฝนเทียมโดยใช้สารเคมีเพื่อทำให้เกิดการควบแน่นของไอน้ำในอากาศกลายเป็น ฝน ในกระบวนการกลั่นน้ำมันปิโตรเลียม ต้องอาศัยหลักการควบแน่นของสาร เป็นต้น
4. การเปลี่ยนสถานะของสารจากของเหลวไปเป็นแก๊ส เช่น การทำน้ำให้เดือดเพื่อฆ่าเชื้อโรคในน้ำ การผลิตกระแสไฟฟ้าจากแรงดันไอของน้ำเดือด เป็นต้น
5. การเปลี่ยนสถานะของสารจากของเหลวไปเป็นของแข็ง เช่น การทำน้ำแข็ง การทำไอศกรีม เป็นต้น
อุณหภูมิกับการเปลี่ยนสถานะ
เมื่อสารได้รับความร้อนจะมีการเปลี่ยนแปลงสถานะ เมื่อสารในสถานะต่าง ๆ ได้รับความร้อน สารจะเกิดการเปลี่ยน
สมบัติของของแข็ง
ของแข็ง (อังกฤษ:solid) เป็น สถานะ ของ สสาร ซึ่งมีลักษณะเฉพาะ ที่สามารถทนและต้านทานต่อการเสียรูปทรง และการเปลี่ยนแปลงในปริมาตรของ ตัวมันเอง มีการจัดเรียงตัวของอนุภาคองค์ประกอบใกล้ชิดกัน แรงยึดเหนี่ยวระหว่างอนุภาคมีค่ามาก อนุภาคของแข็งจึงเคลื่อนที่ไม่ได้ แต่จะสั่นไปมาได้เล็กน้อย เนื่องจากมีช่องว่างระหว่างโมเลกุลน้อยมาก ของแข็งจึงไหลไม่ได้เหมือนของเหลว และอัดไม่ได้เหมือนแก๊ส ของแข็งส่วนใหญ่มีลักษณะเป็นผลึก (crystalline) มีการจัดเรียง มีรูปทรงเรขาคณิตที่แน่นอน หลายแบบที่ระดับจุลภาค (microscopic scale)
สมบัติของของเหลว
ของเหลว Liquid เป็น สถานะ ของ ของไหล ซึ่ง ปริมาตร จะถูกจำกัดภายใต้สภาวะคงที่ของ อุณหภูมิ และ ความดัน และรูปร่างของมันจะถูกกำหนดโดยภาชนะที่บรรจุมันอยู่ ยิ่งไปกว่านั้นของเหลวยังออกแรงกดดันต่อภาชนะด้านข้างและบางสิ่งบางอย่างใน ตัวของของเหลวเอง ความกดดันนี้จะถูกส่งผ่านไปทุกทิศทาง
สมบัติของแก๊ส
ในภาวะที่อุณหภูมิและความดันเหมาะสม สารหลายชนิดสามรถเปลี่ยนสถานะเป็นของแข็ง ของเหลว หรือแก๊สได้ ธาตุที่เป็นอโลหะ เช่น ไฮโดรเจน ฟลูออรีน ออกซิเจน ไนโตรเจน แก๊สเฉื่อย และสารประกอบโคเวเลนต์ที่มีมวลโมเลกุลต่ำบางชนิด เช่น CO , CO2 , NH3 มีสถานะเป็นแก๊สที่อุณหภูมิห้อง
โดยปกติแก๊สมักจะหมายถึงสารที่มีสภานะเป็นแก๊สที่อุณหภูมิห้อง ส่วนสารที่เป็นของเหลวที่ภาวะปกติ แต่ถูกเปลี่ยนแก๊สจะเรียกว่า ไอ (Vapour) แก๊สมีแรงยึดเหนี่ยวระหว่างอนุภาคน้อยมาก อนุภาคจะอยู่ห่างกันมากเมื่อเปรียบเทียบกับของเหลวและของแข็ง ดังนั้น เมื่อบรรจุแก๊สไว้ในภาชนะ แก๊สจึงแพร่กระจายเต็มภาชนะที่บรรจุ ทำให้มีรูปร่างเปลี่ยนแปลงตามขนาดและรูปร่างของภาชนะ แก๊สมีความหนาแน่นต่ำกว่าของแข็งและของเหลวมาก สามารถบีบอัดให้มีปริมาตรลดลงได้
โดยปกติแก๊สมักจะหมายถึงสารที่มีสภานะเป็นแก๊สที่อุณหภูมิห้อง ส่วนสารที่เป็นของเหลวที่ภาวะปกติ แต่ถูกเปลี่ยนแก๊สจะเรียกว่า ไอ (Vapour) แก๊สมีแรงยึดเหนี่ยวระหว่างอนุภาคน้อยมาก อนุภาคจะอยู่ห่างกันมากเมื่อเปรียบเทียบกับของเหลวและของแข็ง ดังนั้น เมื่อบรรจุแก๊สไว้ในภาชนะ แก๊สจึงแพร่กระจายเต็มภาชนะที่บรรจุ ทำให้มีรูปร่างเปลี่ยนแปลงตามขนาดและรูปร่างของภาชนะ แก๊สมีความหนาแน่นต่ำกว่าของแข็งและของเหลวมาก สามารถบีบอัดให้มีปริมาตรลดลงได้
ประเภทของแก๊ส
1. แก๊สอุดมคติ (Ideal gas) หรือเรียกว่าแก๊สสมบูรณ์ หรือแก๊สสมมติ2. แก๊สจริง (Real gas)แก๊สอุดมคติ (Ideal gas) เป็นแก๊สที่ไม่มีอยู่จริง นักวิทยาศาสตร์กำหนดขึ้นเพื่ออธิบายสมบัติต่าง ๆ ที่เกี่ยวกับแก๊ส โดยให้มีพฤติกรรมเป็นไปตามกฎของแก๊สไม่ว่าที่อุณหภูมิหรือความดันใด แก๊สสมบูรณ์เป็นแก๊สที่ไม่มีแรงยึดเหนี่ยวระหว่างโมเลกุลแก๊สจริง (Real gas) หมายถึงแก๊สที่ไม่เป็นไปตามกฎต่าง ๆ ของแก๊สสมบูรณ์ เป็นแก๊สที่มีอยู่จริงในธรรมชาติ มีแรงยึดเหนี่ยวระหว่างโมเลกุลน้อย แต่ในบางสภาวะแก๊สจริงอาจมีสมบัติใกล้เคียงกับแก๊สสมบูรณ์ได้ คือที่อุณหภูมิสูงและความดันต่ำมาก ๆ แก๊สจริงที่มีสมบัติใกล้เคียงกับแก๊สสมบูรณ์มากที่สุดที่อุณหภูมิห้องและความดัน 1 บรรยากาศคือแก๊สเฉื่อย (Innert gas) สมบัติของแก๊สที่ศึกษากันได้แก่ มวล ปริมาตร ความดัน อุณหภูมิ การนำความร้อน และการแพร่ เป็นต้นเมื่อกล่าวถึงแก๊ส จะต้องระบุปริมาตร อุณหภูมิ และความดันด้วย เนื่องจากเป็นสมบัติเฉพาะของแก๊ส (Intensive properties)·ปริมาตร (Volume) ในการวัดปริมาตรของแก๊สใช้หน่วยลูกบาศก์เดซิเมตร (dm3) ถ้าเป็นหน่วยย่อยใช้หน่วยลูกบาศก์เซนติเมตร (cm3)·อุณหภูมิ (Temperature) เครื่องมือที่ใช้วัดอุณหภูมิคือเทอร์มอมิเตอร์ เทอร์มอคัพเพิล และไพโรมิเตอร์ มาตรส่วนที่ใช้วัดอุณหภูมิคือ เซลเซียส (OC) เคลวิน (K) ฟาเรนไฮต์ (F) และโรเมอร์ (R) สำหรับการคำนวณเรื่องแก๊สใช้ เคลวิน หรือเรียกว่าองศาสัมบูรณ์ (Absolute temperature)ความสัมพันธ์ระหว่างเคลวินกับเซลเซียส
| K = 273.15 + OC |
เนื่องจากปริมาตรของแก๊สเปลี่ยนแปลงไปตามอุณหภูมิและความดัน เพื่อความสะดวกในการเปรียบเทียบปริมาตรของแก๊ส จึงกำหนดอุณหภูมิและความดันมาตรฐานขึ้น เรียกชื่อว่าสภาวะอุณหภูมิและความดันมาตรฐาน (Standard Temperature and Pressure : STP) ซึ่งมีอุณหภูมิเท่ากับ 0 OC ความดัน 1 บรรยากาศ หรือ 760 mmHg
ทฤษฎีจลน์ของแก๊ส
เป็นทฤษฎีที่ตั้งขึ้นเพื่อใช้อธิบายกฎ ปรากฏการณ์ หรือผลการทดลองที่เกี่ยวกับแก๊ส และพฤติกรรมของแก๊ส
1. แก๊สประกอบด้วยอนุภาคจำนวนมากที่มีขนาดเล็กมาก จนถือได้ว่าอนุภาคของแก๊สไม่มีปริมาตรเมื่อเทียบกับขนาดภาชนะที่บรรจุ
2. โมเลกุลของแก๊สอยู่ห่างกันมาก ทำให้แรงดึงดูดและแรงผลักระหว่างโมเลกุลน้อยมาก จนถือได้ว่าไม่มีแรงกระทำต่อกัน
3. โมเลกุลของแก๊สเคลื่อนที่อย่างรวดเร็วในแนวเส้นตรง เป็นอิสระ ด้วยอัตราเร็วคงที่ และไม่เป็นระเบียบ จนกระทั่งชนกับโมเลกุลอื่น ๆ หรือชนกับผนังภาชนะจึงจะเปลี่ยนทิศทางและอัตราเร็ว
4. โมเลกุลของแก๊สที่ชนกันเองหรือชนกับผนังภาชนะจะเกิดการถ่ายโอนพลังงานให้แก่กันได้ แต่พลังงานรวมของระบบคงที่
5. ณ อุณหภูมิเดียวกัน โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่ด้วยอัตราเร็วไม่เท่ากัน แต่จะมีพลังงานจลน์เฉลี่ยเท่ากัน โดยที่พลังงานจลน์เฉลี่ยของแก๊สจะแปรผันตรงกับอุณหภูมิเคลวิน
2. โมเลกุลของแก๊สอยู่ห่างกันมาก ทำให้แรงดึงดูดและแรงผลักระหว่างโมเลกุลน้อยมาก จนถือได้ว่าไม่มีแรงกระทำต่อกัน
3. โมเลกุลของแก๊สเคลื่อนที่อย่างรวดเร็วในแนวเส้นตรง เป็นอิสระ ด้วยอัตราเร็วคงที่ และไม่เป็นระเบียบ จนกระทั่งชนกับโมเลกุลอื่น ๆ หรือชนกับผนังภาชนะจึงจะเปลี่ยนทิศทางและอัตราเร็ว
4. โมเลกุลของแก๊สที่ชนกันเองหรือชนกับผนังภาชนะจะเกิดการถ่ายโอนพลังงานให้แก่กันได้ แต่พลังงานรวมของระบบคงที่
5. ณ อุณหภูมิเดียวกัน โมเลกุลของแก๊สแต่ละโมเลกุลเคลื่อนที่ด้วยอัตราเร็วไม่เท่ากัน แต่จะมีพลังงานจลน์เฉลี่ยเท่ากัน โดยที่พลังงานจลน์เฉลี่ยของแก๊สจะแปรผันตรงกับอุณหภูมิเคลวิน
แก๊สที่มีสมบัติเป็นไปตามทฤษฎีจลน์ของแก๊สทุกประการเรียกว่า แก๊สอุดมคติ (Ideal gas) โดยปกติแก๊สทั่วไปจะมีสมบัติเคียงกับแก๊สอุดมคติเท่านั้น สำหรับแก๊สที่มีอนุภาคขนาดเล็ก เมื่อควบคุมให้อยู่ในภาวะที่มีปริมาตรมาก ความดันต่ำ และอุณหภูมิสูง จะมีสมบัติใกล้เคียงกับแก๊สอุดมคติมากขึ้น โดยเฉพาะแก๊สเฉื่อยจะมีสมบัติใกล้เคียงกับแก๊สอุดมคติมากจนอาจจัดเป็นแก๊สอุดมคติได้
ความคิดเห็น
แสดงความคิดเห็น